濃度 計算 問題 239390-濃度計算問題 看護学校
1)水100gにNaClを25g溶かしたときの重量%濃度は? (答え) % 2)5%の食塩水0g中に含まれる食塩は何g? (答え) 10g ※この例題の解説(計算式)は こちらへ 溶液の重量(体積)100万(million)に対する溶質の重量(体積)を表したもの(100万分の1濃度)質量パーセント濃度〔%〕= (溶質の質量〔g〕/溶液の質量〔g〕)×100 (1)は、質量パーセント濃度を求める問題です。 質量パーセント濃度の求め方を覚えていますか? 質量パーセント濃度〔%〕= (溶質の質量〔g〕/溶液の質量〔g〕)×100 この式に、溶液の質量0g、溶質の質量4gを当てはめましょう。 (4g/0g)×100=2% よって、答えは 2% です。濃度計算 質量パーセント濃度を求めよ。 (割り切れない場合は小数第1位を四捨五入して整数で答えよ) 0gの水溶液の中に、溶質が30gが溶けている場合。 水460gに溶質40gを溶かした水溶液。 150gの水溶液のうち、100gが溶媒の場合。 次の問いに答えよ。 濃度8%の水溶液が600gある。 この水溶液中に溶けている溶質の質量を求めよ。 。
初探化学 之 物质的量浓度 计算策略 哔哩哔哩 つロ干杯 Bilibili
濃度計算問題 看護学校
濃度計算問題 看護学校-これは第1回の問題演習より 難易度が上がっています。 第1回の問題演習はこちら、 「濃度計算問題の問題演習①合法カンニングペーパーの使い方」 前回は、1発合法カンペを使えば、 終了の問題でした。 しかし、今回は、それだけでは 解けません。濃度のわからない食塩水MとNがそれぞれ800gずつある。 Mから300gとNから500gを取り出してこれらを混ぜると8%の食塩水になり、残りの食塩水をすべて混ぜてさらに、水を160g加えると10%の食塩水ができる。 MとNの濃度をそれぞれ求めなさい。 式 答



从ph到浓度的转换公式 用计算器将ph值转换为浓 365bet比分直播 Www 7130 Com
化学計算問題 NISHIMURA Yoshikazu 5 濃度②(溶液の希釈,%→mol/L の換算) ★★★ 問題 98 %の濃硫酸(密度18 g/cm3)を水で希釈し,24 mol/L の希硫酸(密度114 g/cm3)を300 mL 作りたい。 (1) この濃硫酸のモル濃度は何mol/L か。107 ×( 51 ・ 10 5 ) = 030 (mg L1) 検量線のグラフを目視で読み取った値と一致しました。 ここまでは、何の問題もなく、濃度を計算で求められる例題です。 分析化学の教科書でも、この辺までは説明されています。濃度(%) 100 はじめの食塩水の濃度をx%とする。 x%の食塩水700gに含まれる食塩は 700×
Jan 09, 質量パーセント濃度の計算問題集応用編 水溶液の濃度を世界で統一した質量パーセント濃度と、その基本練習は終わりましたね。 質量パーセント濃度の計算問題集基本編 科学者たちは、質量パーセント濃度という基準をつくり、世界を発展させたことは学びましたよね。 具体的にいえば、「この溶液が100gあったとき、溶質は何gあるのか? 」を示す指標水溶液濃度計算に関する問題を解決する際に,生徒 は習熟度別にどのような知識・技能が不足していてつ まずいているのかを明らかにし,水溶液濃度計算にお ける学習指導法を検討する. Ⅲ.方法 1.調査対象と調査時期こんな人にオススメ 中学受験を頑張っている小学生 中学校の予習をしたい小学生 テスト勉強したい中学生 子供に理科を教えたい保護者の方
濃度計算の問題です。 (公務員 数的推理) こちらの問題を方程式で解こうとするとどのような式になりますか? 濃度%の食塩水0グラムに対して、次の1〜4の手順を行っ物質 問題 チェックテスト いろいろな物質 密度計算 水溶液 濃度溶解度計算 気体 状態変化 基本問題 いろいろな物質 密度計算問題 身の回りの物質 気体1 気体2 気体3 水溶液の性質 水溶液の性質2 濃度計算問題 アンモニアの噴水実験 メスシリンダーの使い解答:100g 12. 食塩15gと水285gを混ぜ、火にかけていきました。 (1)すべて混ざり合うと濃さは何%ですか。 (2)火をかけ続け、水が何gか蒸発したので、濃さを調べたところ、10%でした。 水は何g蒸発しましたか。 解説: (1)食塩水の公式から 15÷(15+285)=005→5%。




物质的量浓度魔鬼计算题 哔哩哔哩 つロ干杯 Bilibili



小学奥数知识点汇编大全之二 浓度问题 认识图形 奥数网
1 (1)答8% 解説 質量パーセント濃度 = 溶質 (g) 溶液 (g) ×100より 250 ×100=8 (2)答 250g % 解説 ① 砂糖水 (溶液) = 砂糖 (溶質)水 (溶媒) より 500=250 ② 質量パーセント濃度 = 溶質 (g) 溶液 (g) ×100より 50 250 ×100= (3)答375% 解説 砂糖水 (溶液) = 砂糖 (溶質)水 (溶媒) より 砂糖水の質量は=160g 質量パーセント濃度 = 溶質 (g) 溶液 (g) ×100よ濃度の計算 「溶液=溶質+溶媒」を思い出そう! 小中学校で、食塩水の濃度を求める計算問題を解いた記憶があると思います。"食 塩水(溶液)は、食塩(溶質)が水(溶媒)に溶けているもの"、ということを思い 出しましょう。Nov 07, 19最初に触れましたが、質量パーセント濃度は以下の式で求められます。 質量パーセント濃度 (%)= 溶質の質量(g)÷ 溶液(溶質溶媒)の質量(g)×100




溶液中离子浓度计算的一种好方法 参考网
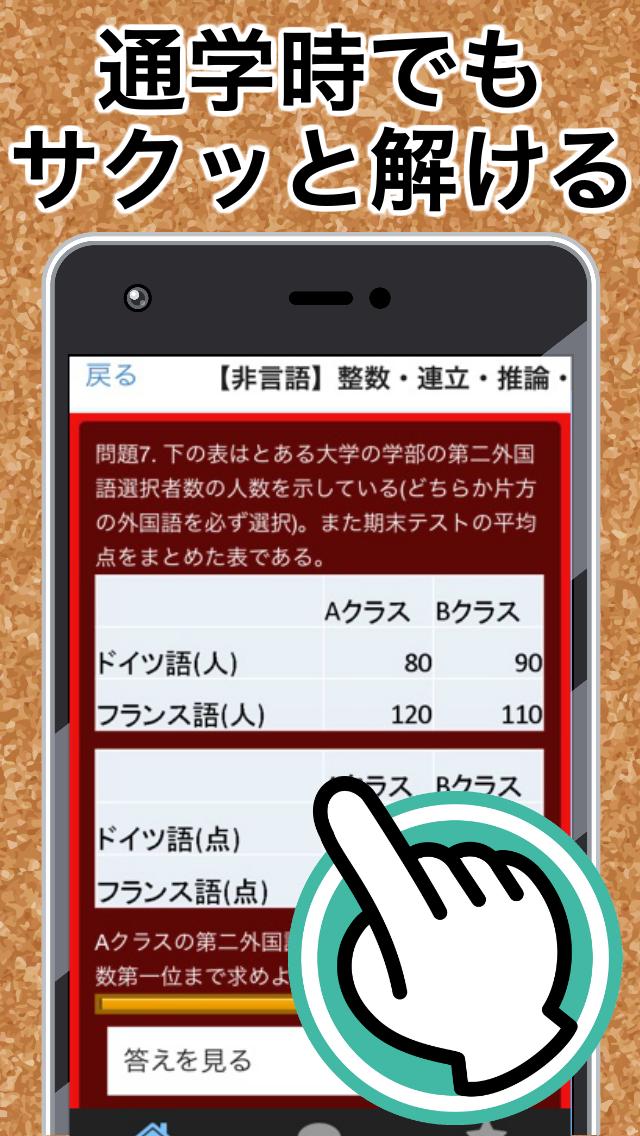



Spi3 問題無料 言語非言語テストセンターwebテスト就職一般常識濃度計算 安卓下載 安卓版apk 免費下載
濃度を計算する問題 2組の入口へ 説明へGO 1 水酸化ナトリウムの結晶gを水80gに溶解させ、水酸化ナトリウム水溶液を作る。この水溶液の密度を12g/cm 3 とするとき、以の濃度を求めよ。 (原子量H=10,O=16,Na=23) 1,質量パーセント濃度 2,モル濃度て困った事態に陥らないよう,比較的ヒマな1年生のうちに,濃度計算方法 p284練習問題1111(a),Na 2CO 3=106 p284練習問題1111(b),H 3PO 4=98 p284練習問題1111(c),KMnO 4=158 p285練習問題1113,1 dLは01 L p303復習問題3,H 2SOFeb 07, 17(質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×100 だったね?? 質量パーセント濃度の問題をクリアするコツとしては、 公式を使う前に溶質・溶媒・溶液の情報を整理すること だ。 慌てずにゆっくりと計算公式を使っていこう。 そんじゃ




濃度を求める問題 プロ家庭教師あゆこ先生の勉強応援ブログ



高校生物基礎 腎臓のイヌリン濃縮率や原尿量などの計算問題の解き方 高校生物の学び舎
Aug 11, 17ここでは体積モル濃度(以後単にモル濃度と表します。)について計算問題を解いて行きます。 モル濃度計算でやっておきたい単位換算と公式の確認 モル濃度は \(\mathrm{mol/L}\) が単位なので溶液が \(\mathrm{L}\) 単位であれば問題はないのですが、濃度を にするには 薬品を g (グラム) mg (ミリグラム) ml (ミリリットル) cc (シーシー) l (リットル) kg (キログラム) m3 (立方メートル) いれる。 使い方 数値を入れて、計算ボタンを押します。Feb 22, 21濃度問題について 濃度問題は毎年45問目に出題されていました。 (年は出ませんでした。 ) 単位の変換(換算)と割り算・掛け算ができれば易しい問題となります。 出題される問題は 3パターン です。 出題パターン1:出来上がった溶液の濃度を求める問題 出題パターン2:最初の溶液の量を求める問題 出題パターン3:加えた水の量を求める問題




公务员考试 行测涉及的计算公式都在这里了 教育频道 手机搜狐



食塩水問題 基本原形
X 100 =7x(g) 水を300g蒸発させると食塩水の質量は=400gとなる。 7%の食塩水400gに含まれる食塩は 400×第Ⅱ章 栄養士のための割合を使った計算問題 第Ⅰ章で、割合計算の基礎を学んできましたが、割合の基礎が分かれば、栄養士に必要な計 算問題は、少しの応用でできるようになります。 第1節 三大栄養素に関する計算問題 例題112. 食塩15gと水285gを混ぜ、火にかけていきました。 (1)すべて混ざり合うと濃さは何%ですか。 (2)火をかけ続け、水が何gか蒸発したので、濃さを調べたところ、10%でした。 水は何g蒸発しましたか。 13. 4%の食塩水300gに食塩を2g入れて、火にかけて、水を蒸発させたところ、 5%の食塩水になりました。 水は何g蒸発しましたか。



氯化钠溶液在生产 生活中都有广泛的用途 现配置1 L 0 2 Mol L Nacl溶液 请回答问题 高中一年级 化学试题 配制一定物质的量浓度 的溶液考点 好技网




Spi3 問題無料 言語非言語テストセンターwebテスト就職一般常識濃度計算 安卓下載 安卓版apk 免費下載
Feb 14, 濃度の違う食塩水を混ぜる問題の解き方1計算問題付 それでは、濃度算に関する練習問題を解いていきましょう。 ・例題1 濃度が5%の食塩水0gと、濃度が10%の食塩水300gを混ぜた際の濃度は何パーセントになるでしょうか。 ・解答1モル濃度を求める問題では、ほとんどの場合、ここがスタートになります。 質量パーセント濃度〔%〕=(溶質の質量〔g〕/水溶液の質量〔g〕)×100 次に、密度と質量パーセント濃度を使って、 溶質の質量 を求めましょう。Jun 14, 19一般常識「濃度算」の練習問題(高校生対応) 投稿日:19年6月14日 更新日:19年6月16日 <例題1> 食塩40gを1gの水に溶かすと何%の食塩水ができるか。 ≫ 例題1の解答・解説を見る 答え:25% 食塩の濃度は次の式で求めます。 濃度(%)=食塩の量÷食塩水の量×100 分数にすると ここで注意したいのは、食塩水は「食塩+水」であるということ。




14溶液计算 稀释 浓缩问题溶液初中化学 Youtube




高中化学考点归纳6 一定物质的量浓度溶液的配制与计算 王羽课堂
問題9 点滴で水分を1日に1500ml補給する患者がいます。 1時間に何ml入るようにセットすればいいですか。 計算では1の位を四捨五入してください。 問題10 成人は体重1kgあたり50mlの水分が必要です。 体重48kgの点滴を女性の患者では濃度算(食塩水問題)の文章問題計算ドリル/問題集 管理人 11月 2, 18 小学校算数の割合に関する文章問題として代表的なもののひとつ「濃度算」。 これの問題集です。 基本の公式を抑えるための問題と、文章問題を用意しました。 問題をランダムで生成することができ、答えの表示・非表示も切り替えられます。 印刷してご活用ください。 文章問題はJan 02, 質量パーセント濃度の計算問題集基本編 科学者たちは、質量パーセント濃度という基準をつくり、世界を発展させたことは学びましたよね。 具体的にいえば、 「この溶液が100gあったとき、溶質は何gあるのか? 」 を示す指標です。 水溶液には、溶質と溶媒があります。 溶媒が水であれば、水溶液とよぶ。 溶媒がエタノールなど、他の物質の場合もある




Spi3 問題無料 言語非言語テストセンターwebテスト就職一般常識濃度計算 安卓下載 安卓版apk 免費下載




国考行测数量关系指导之用 溶质 突破浓度问题 哔哩哔哩
含まれる食塩(g) = 食塩水(g) ×Jan 01, 18濃度計算のコツ~まずはこのやり方を覚えよう~ (例)10%塩化ナトリウム水溶液を用いて、02%塩化ナトリウム溶液を500ml作るために必要な10%塩化ナトリウム水溶液量は何mlか。 ※この問題の場合、原液は10%塩化ナトリウム水溶液ということになります。了解濃度單位和稀釋度 計算化學溶液的濃度是一項基本技能,所有化學學生都必須在學習的早期階段發展。 什麼是集中? 濃度是指溶解在溶劑中的溶質的量。 我們通常認為溶質是加入到溶劑中的固體(例如,向水中加入食鹽),但溶質可能同樣容易存在於另一個相中。




Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ




浓度问题 知乎
7 100 =28g 濃度(%) x 0(水) 7 食塩水(g) 400 含ま(未知試料 の濃度) = ×



浓度问题




3种方法来计算溶液浓度



初探化学 之 物质的量浓度 计算策略 哔哩哔哩 つロ干杯 Bilibili




物质的量浓度计算公式都有什么 卓博教育网



基础课 甲醛含量的两个单位ppm与mg M 的关系
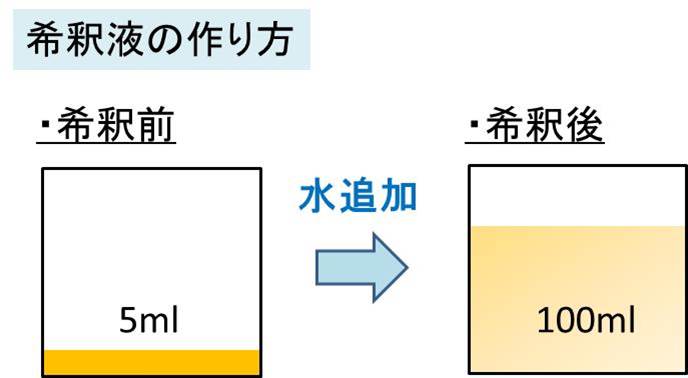



希釈液の作り方の計算方法は 濃度との関係は 問題付き



高考化学专题复习2 3 溶液浓度的计算 高考 学习资料大全 免费学习资源下载
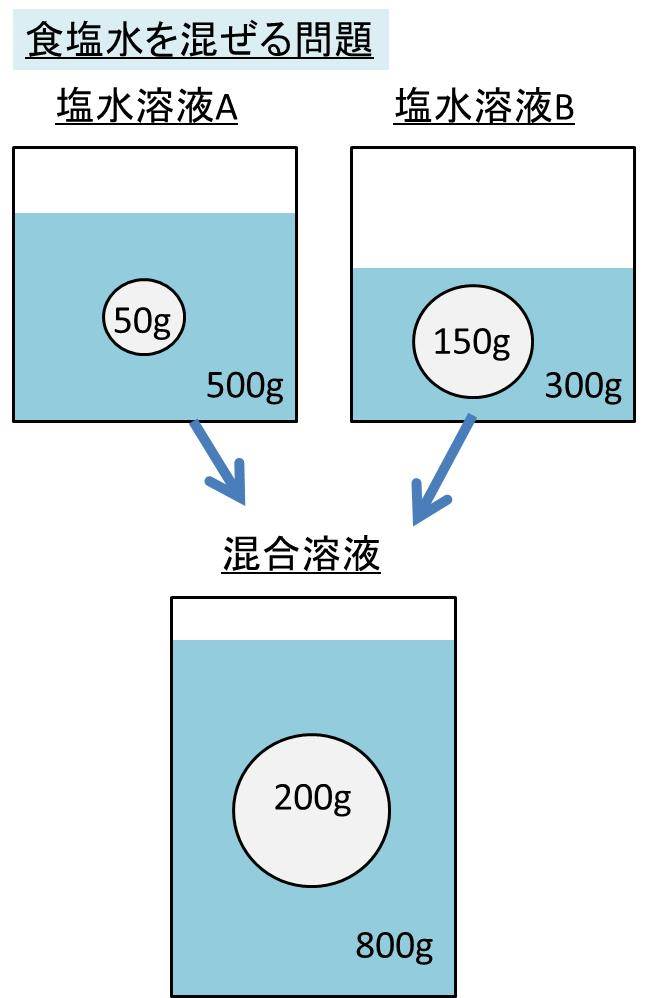



Spi 異なる濃度の食塩水を混ぜる問題の計算方法 濃度算




浓度怎么换算成对数 三人行教育网 Www 3rxing Org



速解丨数量关系中的浓度问题 应用



课题3溶液的浓度教案下载 Word模板 爱问共享资料



食鹽水濃度計算題 數學板 Dcard



11届化学高考一轮复习教学案第05讲物质的量浓度下载 Word模板 爱问共享资料




小學數學寒假自補 濃度問題口訣及解題方法附經典應用題及答案 每日頭條




溶液的浓度 教学设计 初中化学 人民教育出版社官方网站 人教网 人教版 部编本



行测80分必备 数学运算经典题型全集下载 Word模板 爱问共享资料



日本东电拟排放核污水前不测放射性物质浓度 日网友批 想敷衍了事




稀释溶液公式 初中化学问题 溶液稀释的计算公式是什么 三人行教育网 Www 3rxing Org




如何计算溶液浓度 生活百科




質量パーセント濃度の計算問題集 応用編 Menon Network
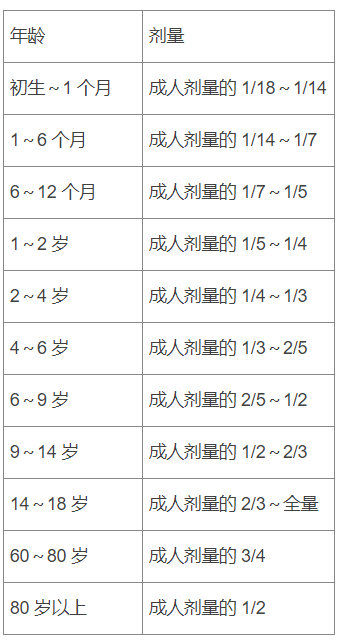



临床锦囊 常用护理计算公式 看这篇文章就够了




我的記事簿 Scr Pfd 計算過程 1 8



科学网 测的水质氯化物 为啥监测报告中是氯离子 霍小鹏的博文




3种方法来计算溶液浓度




濃度與配比問題 每日頭條




モル計算 濃度計算などの問題 解説 レベルa2 ともよし塾 受験と科学の解説授業
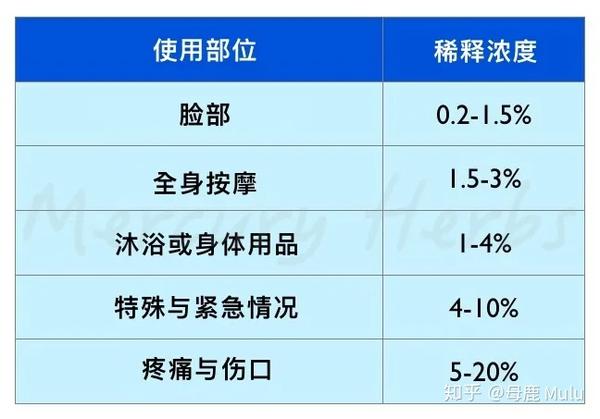



实用 精油浓度计算表 请收藏 知乎




4种计算摩尔浓度的方法 提示 21




摩尔浓度的计算



从ph到浓度的转换公式 用计算器将ph值转换为浓 365bet比分直播 Www 7130 Com




高中化学考点归纳6 一定物质的量浓度溶液的配制与计算 王羽课堂




5种计算溶液浓度的简便方法 百科全书 21




高中化學之由水電離出的氫離子和氫氧根離子濃度計算問題解析 每日頭條




高中化学考点归纳6 一定物质的量浓度溶液的配制与计算 王羽课堂




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu



课时4 物质的量在化学方程式计算中的应用下载 Word模板 爱问共享资料




これで分かる モル濃度計算の解き方 大村升次郎 大村升次郎 本 通販 Amazon



求助 关于营养液山崎配方中浓度计算问题 农林 小木虫 学术科研互动社区



两道题搞懂a Level化学kpc题型 翰林国际教育




小学数学浓度问题 抓住两个量 就没有难度了 柬埔寨头条
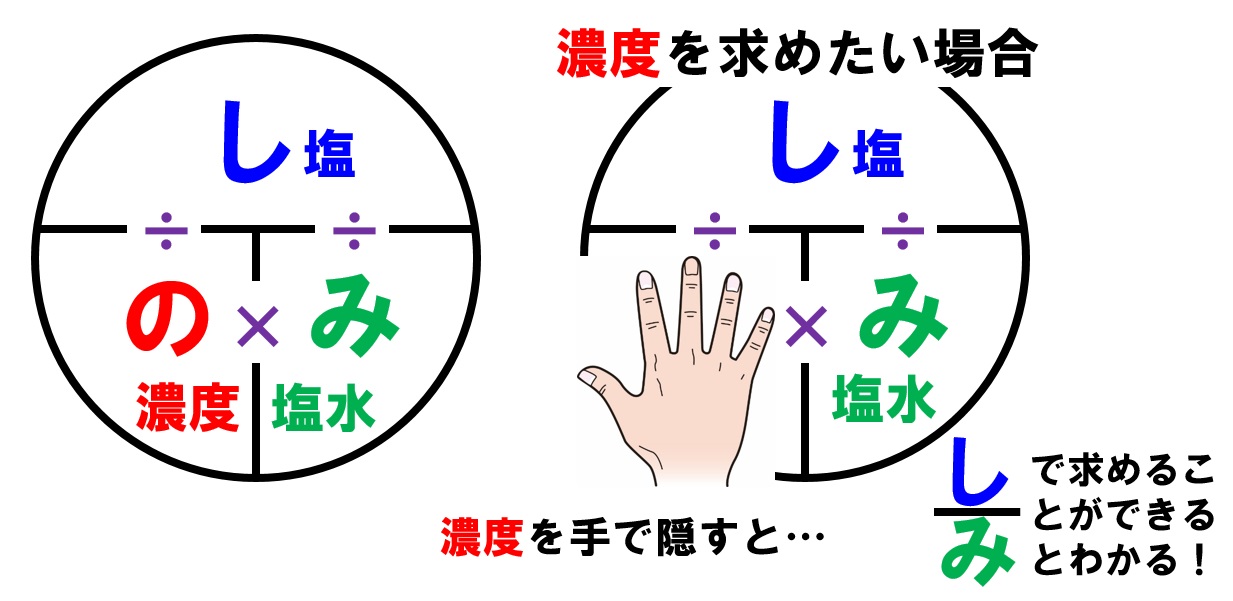



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




如何计算初始浓度 科学 21




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット



高中化学专题知识讲解 过量计算问题归类解析 高中化学 学习资料大全 免费学习资源下载



普通化學濃度計算問題 考試板 Dcard



浓度的计算公式浓度计算公式数学 麦税尼网




3种方法来计算溶液浓度




中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




4种方法来算出体积摩尔浓度 Molarity




體積莫耳濃度的文章和評論 痞客邦



摩尔浓度计算 西瓜视频搜索
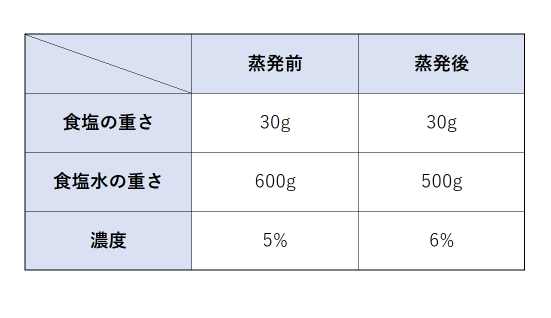



濃度計算の公式はどうして成り立つの 食塩水の問題を割合として理解しよう 中学受験ナビ
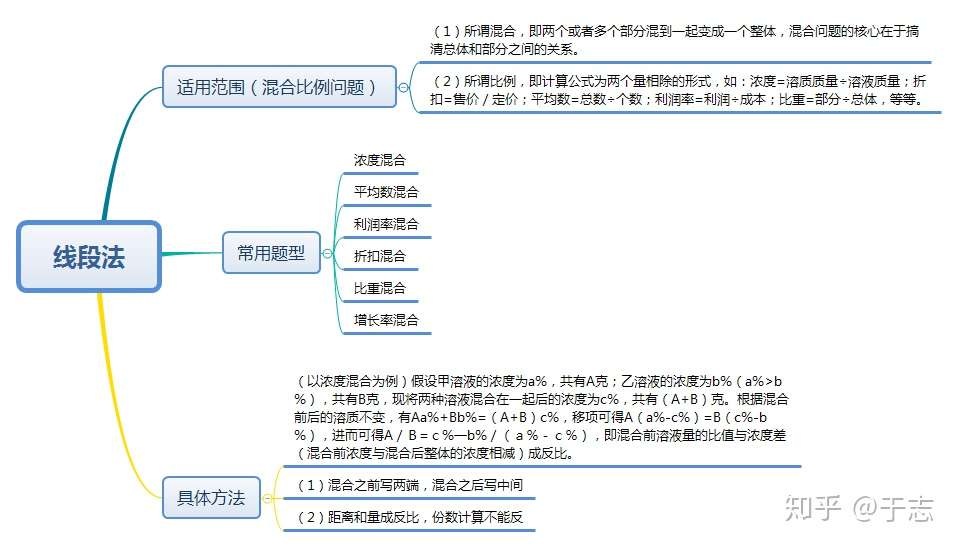



数量关系 核心方法 线段法 知乎



物质的量计算 腾讯视频




小升初數學之求陰影面積問題 濃度問題最全講解 每日頭條



浓度计算公式有哪些 高三网




高考化学总复习专题一 化学常用计量及其应用 知乎



溶液配制神器 摩尔浓度自动计算excel工具 艾美捷奉献 企业动态 丁香通




小學數學寒假自補 濃度問題口訣及解題方法附經典應用題及答案 每日頭條




溶液配制神器 摩尔浓度自动计算excel工具 艾美捷奉献 企业动态 丁香通



十字交叉法计算 腾讯视频
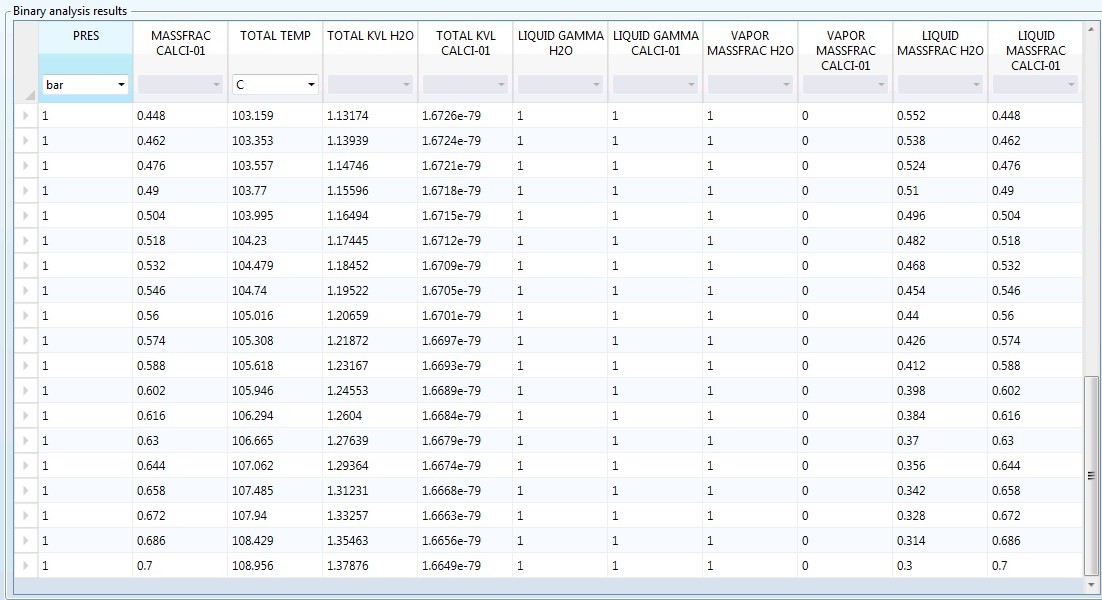



利用apsen计算氯化钙 Cacl2 水溶液沸点的问题利用aspen计算氯化钙水溶液的沸点 在1bar 浓度 70 下 采用物性方法为elecnrtl 经过模拟计算出沸点为109度 这和工具书上查出来的175度相差甚远 不知道是什么原因是物性



公考行測秒殺技巧 濃度問題解題方法 愛經驗



0 02m的溶液 西瓜视频搜索



速解丨数量关系中的浓度问题 应用



11年高考化学专题讲练 第五讲 物质的量浓度下载 Word模板 爱问共享资料




中学理科 計算問題 質量パーセント濃度の計算 Youtube




静脉滴注阿奇霉素 为什么浓度越高滴速越快
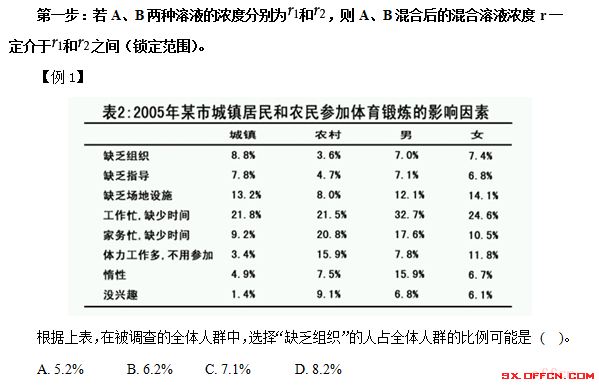



山西公务员行测数学运算 平均量 混合问题速算 教育频道 手机搜狐




濃度算 食塩水問題 の文章問題 計算ドリル 問題集 数学fun




浓度问题 知乎



名師課輔網 體積百分濃度
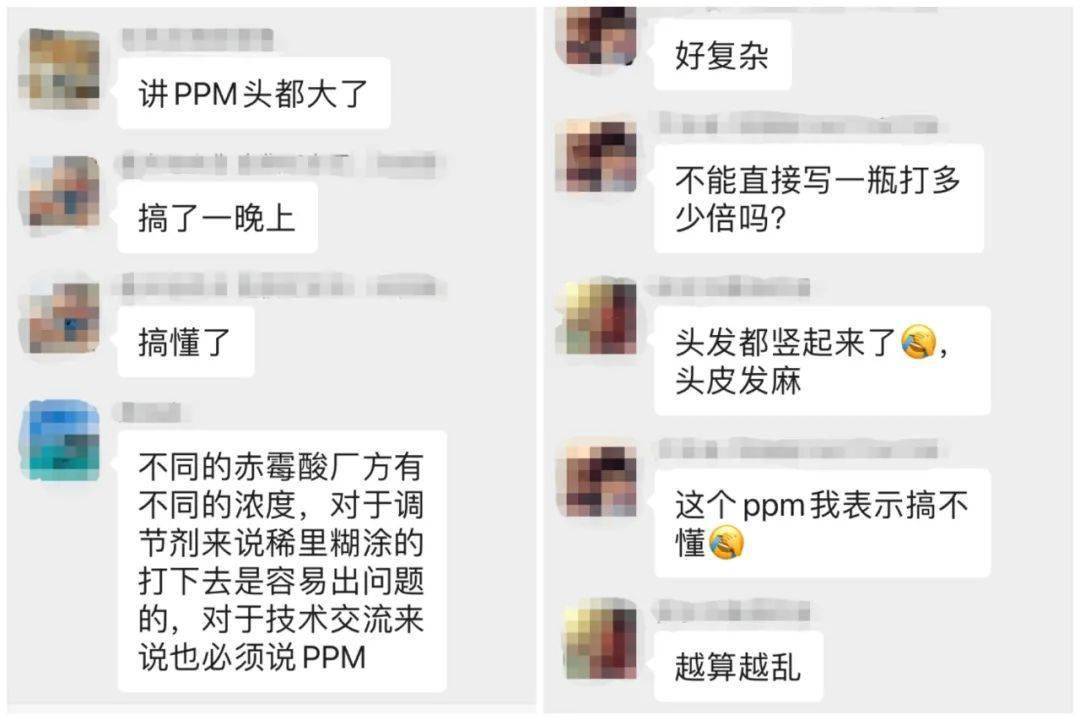



Ppm怎么换算 打药配多少水 一秒就知道 这个计算工具简直太方便了 Ppm




怎么算出体积摩尔浓度 Molarity 生活百科




質量パーセント濃度の計算問題集 応用編 Menon Network




标液的稀释 分析测试百科网




溶液配制神器 摩尔浓度自动计算excel工具 艾美捷奉献 企业动态 丁香通



粉笔网




小学数学浓度问题 抓住两个量 就没有难度了 Tnaot



小学五年级数学浓度问题知识点讲解 五年级奥数题 奥数网
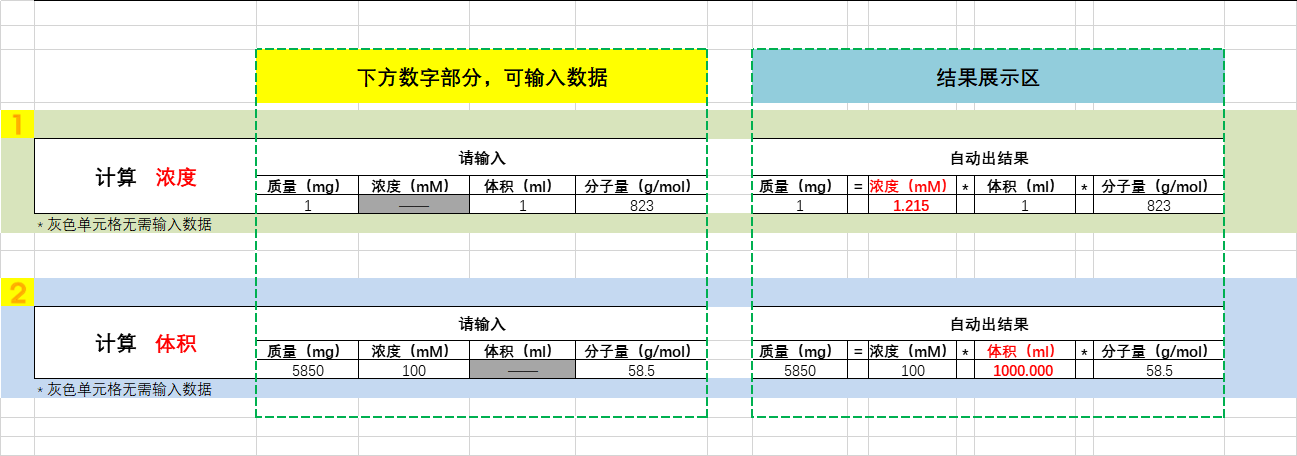



溶液配制神器 摩尔浓度自动计算excel工具 艾美捷奉献 企业动态 丁香通




高中化學之由水電離出的氫離子和氫氧根離子濃度計算問題解析 每日頭條



数学运算 计算问题之算式计算 91up快学堂




質量パーセント濃度の計算問題集 基本編 Menon Network
コメント
コメントを投稿